Sanofi và Regeneron Pharmaceuticals hợp tác nghiên cứu sản phẩm giảm choleterol hiệu quả
Sanofi và Regeneron Pharmaceuticals, Inc đã công bố kết quả của một thử nghiệm giai đoạn 3 của Praluent (alirocumab) trong 18 tháng (78 tuần) , một liệu pháp điều tra nghiên cứu, liên quan đến 2.341 nguy cơ cao bệnh nhân tăng cholesterol máu đã được công bố trực tuyến trên tờ The New England Journal of Medicine. Trong các thử nghiệm ODYSSEY DÀI HẠN, Praluent 150 mg mỗi hai tuần giảm mật độ lipoprotein cholesterol thấp (LDL-C hay cholesterol "xấu") bằng 62% thêm vào tuần thứ 24 khi so sánh với giả dược, Hiệu quả chính của nghiên cứu, với phù hợp LDL-C giảm duy trì trong 78 tuần

Logo Sanofi toàn cầu. Ảnh: internet
Những kết quả này chứng minh hiệu quả lâu bền cho Praluent khi thêm vào tối đa dung nạp liệu pháp statin và tiếp tục củng cố hồ sơ an toàn nói chung ổn định," cho biết Jennifer Robinson, MD, MPH, Giám đốc Trung tâm Phòng chống can thiệp, Giáo sư, Sở dịch tễ và Y học, Trường Đại học Y tế công cộng tại Đại học Iowa. "Ngoài ra, việc phân tích giả thuyết hậu nghiệm(post hoc) các biến cố tim mạch chính đại diện cho một phát hiện quan trọng cho Praluent - chúng tôi mong muốn kết quả từ thử nghiệm ODYSSEY liên tục, được hồi tố đánh giá tiềm năng của Praluent để giảm biến cố tim mạch."
18-Tháng (78 tuần) an toàn và tính hiệu quả kết quả
ODYSSEY LONG TERM đánh giá Praluent 150 mg (n = 1553) mỗi hai tuần so với giả dược (n = 788) ở bệnh nhân có bệnh tim mạch cao (CV) rủi ro và những người đã được điều trị bằng statin tối đa dung nạp có hoặc không có hạ lipid máu điều trị khác. Các thử nghiệm bao gồm những bệnh nhân có tăng cholesterol máu do di truyền (HeFH) (n = 276 Praluent, n = 139 placebo). Các bệnh nhân được 78 tuần điều trị tiếp theo là một đánh giá an toàn 8 tuần. Bệnh nhân tự tiêm một liều tiêm dưới da mỗi hai tuần qua một ống tiêm điền sẵn. Các kết quả chính bao gồm:
Ở tuần thứ 24, Praluent giảm LDL-C từ đường cơ sở thêm 62% so với giả dược (p <0,0001) khi thêm vào các tiêu chuẩn hiện hành về chăm sóc, trong đó bao gồm statin tối đa dung nạp. Hiệu quả vẫn nhất quán thông qua điều trị, và ở tuần 78 thì giảm 56 phần trăm so với ban đầu LDL-C cho Praluent so với giả dược (p <0,0001).
Ở tuần thứ 24, 81% bệnh nhân trong nhóm Praluent đạt được mục tiêu xác định LDL-C (hoặc 70 mg / dL [mg / dL] hoặc 100 mg / dL tùy thuộc vào nguy cơ tim mạch cơ bản) so với 8,5% đối với giả dược ( p <0,0001).
Các tác dụng phụ (AES) xảy ra ở 81% và 83% Praluent bệnh nhân dùng giả dược, dẫn đến việc ngưng trong 7,2%và 5,8% bệnh nhân. AES là tương tự giữa các nhóm, ngoài sự khác biệt trong phản ứng tại chỗ tiêm (5,9% Praluent, 4.2% placebo), đau cơ (5,4% Praluent, 2,9% placebo), nhận thức thần kinh (1,2% Praluent, 0,5% placebo), và trên mắt ( 2,9% Praluent, 1,9% placebo). Trong một 3759 bệnh nhân, phân tích an toàn gộp chín nghiên cứu Praluent kiểm soát giả dược được trình bày vào ngày thứ Hai, tỷ lệ các vấn đề liên quan đến cơ và nhận thức thần kinh xương nói chung cân bằng giữa Praluent và giả dược.
Ở tuần thứ 78, 'biến cố tim mạch bất lợi lớn "xảy ra trong 4,6% và 5,1% Praluent và giả dược cho bệnh nhân. Trong một bài phân tích giả thuyết hậu nghiệm sử dụng điểm cuối được xác định trước đó về bệnh tim mạch vành chết, nhồi máu cơ tim, đột quỵ, đau thắt ngực không ổn định hoặc cần nhập viện, một tỷ lệ thấp hơn của các vấn đề tim có hại chính phân xử được quan sát thấy trong các nhóm Praluent (27 1550 bệnh nhân, 1,7%) so với nhóm dùng giả dược (26 788 bệnh nhân, 3,3%; tỷ số nguy cơ 0,52; CI 95%=0,31-0,90; p< 0,01). Các đường cong tỷ lệ tích lũy tách dần theo thời gian.
ODYSSEY LONG TERM không được thiết kế để đánh giá kết quả CV. Những vấn đề về tim mạch được tìm thấy trong phân tích post hoc là tương đối nhỏ, làm hạn chế khả năng để đưa ra kết luận về ảnh hưởng của các sự kiện trên Praluent CV. Các thử nghiệm liên tục ODYSSEY OUTCOME sẽ đánh giá những lợi ích CV của Praluent trong khoảng 18.000 bệnh nhân trên 5 năm.
Giới thiệu về Praluent
Praluent là một kháng thể đơn dòng tác dụng lên mục tiêu là PCSK9 (proprotein convertase subtilisin / Kexin loại 9) kháng thể đơn dòng. Đầu năm nay, Regeneron và Sanofi thông báo rằng Biologics License Application (BLA) cho Praluent được chấp nhận xem xét ưu tiên bởi các Thực phẩm và Dược phẩm Hoa Kỳ (FDA). Theo Prescription Drug User Fee Act (PDUFA), mục tiêu cho một xét ưu tiên là sáu tháng, ngày mục tiêu cho hành động là ngày 24 tháng 7, năm 2015. Ngoài ra, các cơ quan y tế châu Âu (EMA) chấp nhận xem xét quảng cáo sản phẩm Praluent trong Liên minh châu Âu. EMA và FDA đã chấp nhận điều kiện Praluent như tên thương mại cho alirocumab. Sự an toàn và hiệu quả của Praluent chưa được đánh giá đầy đủ bởi bất kỳ cơ quan quản lý nào.
Về Sanofi
Sanofi, một hãng dược phẩm hàng đầu thế giới tích hợp toàn cầu, phát hiện, phát triển và phân phối các giải pháp điều trị tập trung vào nhu cầu của bệnh nhân. Sanofi có thế mạnh cốt lõi trong lĩnh vực chăm sóc sức khỏe với 7 mảng tăng trưởng thế mạnh: giải pháp tiểu đường, các loại vacxin, thuốc sáng tạo, chăm sóc sức khỏe người tiêu dùng, thị trường mới nổi, thú y và Genzyme mới.
Về Regeneron Pharmaceuticals, Inc.
Regeneron (NASDAQ: REGN) là một công ty dược phẩm sinh học dựa trên khoa học hàng đầu có trụ sở tại Tarrytown, New York phát hiện ra rằng, phát minh, phát triển, sản xuất, và thương mại hóa các loại thuốc để điều trị các bệnh nghiêm trọng. Regeneron thương mại hóa các loại thuốc cho các bệnh về mắt, và một tình trạng viêm hiếm và có các ứng cử viên phát triển sản phẩm trong các lĩnh vực khác của y tế chưa được đáp ứng nhu cầu cao, bao gồm tăng cholesterol máu, ung thư, viêm khớp dạng thấp, hen suyễn và viêm da dị ứng. Để biết thêm thông tin về công ty, xin vui lòng ghé thăm www.regeneron.com.
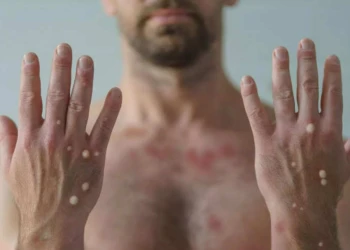
Hướng dẫn cách phân biệt bệnh đậu mùa và đậu mùa khỉ
Cách phân biệt bệnh đậu mùa và đậu mùa khỉ qua phương thức lây nhiễm và các triệu chứng trên da. Hãy cùng xem cách phân biệt bệnh đậu mùa và đậu mùa khỉ
Chi tiết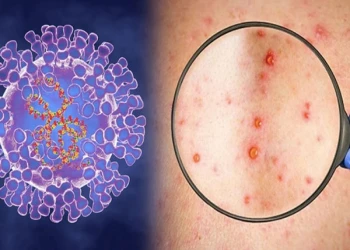
Bệnh đậu mùa khỉ có nguy hiểm không, làm sao để phòng chống?
Bệnh đậu mùa khỉ có nguy hiểm không? và làm thế nào để phòng ngừa? Đậu mùa khỉ là bệnh truyền nhiễm có tốc độ lây lan mạnh, vậy bệnh đậu mùa khỉ có nguy hiểm không
Chi tiết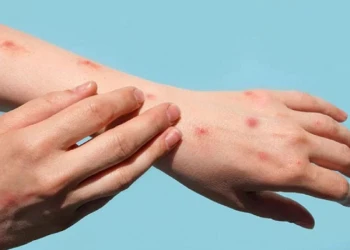
Bệnh đậu mùa khỉ lây qua đường nào và những dấu hiệu nhận biết
Bệnh đậu mùa khỉ lây qua đường nào, và làm thế nào để nhận biết sớm về bệnh? Thông tin về bệnh đậu mùa khỉ lây qua đường nào sẽ có trong bài viết này.
Chi tiết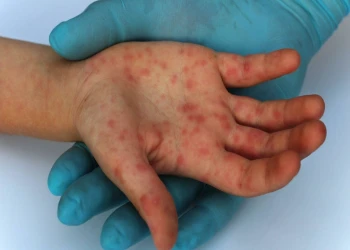
Góc giải đáp: Bệnh đậu mùa khỉ là gì, dấu hiệu nhận biết và cách điều trị ra sao?
Bệnh đậu mùa khỉ là gì? Đậu mùa khỉ là loại bệnh hiếm gặp, bệnh do virus đậu mùa khỉ gây ra. Bệnh đậu mùa khỉ có thể xảy ra ở mọi lứa tuổi và đối tượng.
Chi tiết
Cẩm nang về bệnh suy tim: Nguyên nhân, cách chẩn đoán và điều trị
Suy tim là một trong những loại bệnh thường gặp và nguy hiểm. Và bài viết này sẽ giúp bạn biết suy tim là gì, nguyên nhân, cách chẩn đoán và điều trị,... ra sao.
Chi tiết
Mách bạn: Cách bảo vệ và chăm sóc mắt vào mùa đông giúp mắt sáng khỏe
Cách bảo vệ và chăm sóc mắt vào mùa đông ra sao? Bài viết này, chúng tôi sẽ mách bạn cách bảo vệ và chăm sóc mắt vào mùa đông giúp mắt luôn sáng khỏe.
Chi tiếtBình luận
Bạn hãy là người đầu tiên nhận xét về sản phẩm này